一、假阳性产生的原因。
这是免疫学方法都逃不开的问题,但是各种方法学在忽悠别人的理由都不一样,这里就详细的介绍一下胶体金常见假阳性和假阴性的原因。
(一)抗体与胶体金颗粒间的作用力
大多数假阳性产生原因是相似性问题,即在通常结合反应中蛋白与胶体金颗粒特异性结合,结合过程中蛋白质被三种主要作用力吸附在胶体金表面。
1.电荷引力 氯金酸转化为胶体金时,还原剂(通常是柠檬酸盐)带有的一层负电荷被吸附在胶体金颗粒表面。负电荷将吸引带正电荷的蛋白且使其靠近结合区表面,从而可能造成假阳性的产生。
低于等电点的蛋白带正电荷,可能会与胶体金颗粒表面发生强烈吸引作用,尤其在带有富含赖氨酸和精氨酸的蛋白质区域低于赖氨酸等电点(PH10.4)和精氨酸等电点(PH12.5)时会带有大量正电荷。
2.疏水作用力 一旦蛋白质彼此十分接近(距离约小于1nm),那么蛋白质的任何疏水区则可能与胶体金表面的疏水区接触并与之结合。
因此富含非极性氨基酸(例如色氨酸、亮氨酸等)的蛋白质就会与胶体金表面发生强结合作用。
3.配位键结合力 配位键结合力是所有吸引力中最强的结合力,这是金原子(具有传导带电子的能力)和硫原子(带有价电子)之间的强吸引力造成的。因此富含硫的氨基酸的蛋白质与胶体金颗粒表面产生很强的结合力。
当这三种结合力作用于胶体金标记颗粒时,会产生假阳性信号并且对检测结果产生不良影响。
(二)假阳性产生的原因
图5-10
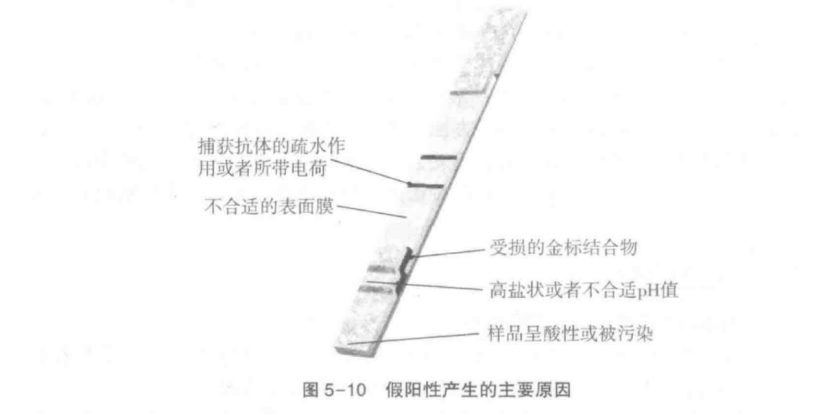
简要描述了试纸条中需要关注的主要区域以及导致假阳性产生的大多数原因,但这些并不包括假阳性产生的所有原因和情况。总是,产生假阳性信号的所有可能原因与金标粒子、捕获抗体、硝酸纤维素膜、所加化学试剂以及样品都有密切关系。通过对这些潜在影响因素的充分理解,在实验操作过程中即可根据某些特征,迅速判断造成假阳性产生原因。
1.金标粒子原因 如果由于某种原因金标粒子表面没有被蛋白质全部覆盖而造成部分裸露或者金标涂得很少,那么在金标液干燥或者检测过程中就会导致抗体丢失,但是裸露的胶体金颗粒均会被任何带有正电荷的蛋白质或硝化纤维素或尼龙膜所吸附。导致当胶体金颗粒通过捕获线时距离很小而物理接触很大。因此对胶体金颗粒的有效包被且使蛋白质在储存、处理或操作中不脱落这两点至关重要。
除胶体金颗粒对捕获线吸附外,标记抗体本身可能在特定操作条件下被捕获线吸附。这种情况可由两方面原因造成:一是电荷或疏水作用力,二是反应过程中酸性或离子环境。
过量金标粒子也会产生问题,一是可能增加捕获线假阳性信号或者大量金标液通过捕获线,二是检测后增加过量金标粒子回流的可能性,而优质金标液则不需过量使用。
造成胶体金颗粒聚集成簇的原因很多,但通常是操作失误造成过多胶体金簇堵塞膜孔。如果成簇原因是胶体金的疏水作用力,那么金标液在流动过程中胶体金颗粒会黏附在捕获抗体上,无论待测物是否存在,金标抗体都会与捕获抗体发生非特异性免疫反应。虽然 ELISA 技术中抗体间可能不经常发生类似反应,但这种情况会使硝酸纤维素膜上的标记抗体与捕获抗体非常接近从而增加发生非特异性免疫反应的可能性。另外,特别是使用多克降抗体时可能会发生与样品中其他待测物的非特异性反应。这种非特异性反应的发生与否主要取决于使用抗体的纯度,
2.伴随捕获抗体而产生的假阳性信号 许多因素可能会导致捕获抗体发生非特异性结合反应。产生假阳性信号的原因有以下几方面引起:疏水作用力、非特异性免疫反应、抗体添加物、带有大量正电荷、与胶体金颗粒吸附的捕获抗体富含高浓度含硫氨基酸。标记过程中,这些因素都会使抗体与胶体金颗粒表面吸附并与其结合。实际工作中,作用于捕获抗体的这些因素会影响到快速检测技术的最终结果。
与固相支持物相关的硝酸纤维素膜很脆目接触时很易破坏,因此在撕开膜的过程中应尽量避免与膜发生任何可能的机械接触。如果应用捕获抗体时膜被压在捕获抗体带上,那么在样品流动过程中,会提高金标粒子发生非特异性反应的可能性。
有两个原因能使残余胶体金颗粒吸附在捕获抗体带上,一个原因是金标粒子在膜中流速太慢,另一个原因是胶体金垫释放速度太慢。如果孔径太小或者检测带上没有足够活性物质,再加上硝酸纤维素膜与金标液或与吸收垫接触不良,那么胶体金颗粒就会附着在捕获抗体带上。此外,由于硝酸纤维素膜是疏水的,会阻碍金标液流动。另外,有些黏性样品(血清)也会使流速减慢。当检测体系中样品或活性物质的量不足以使金标沿着检测带移动时,胶体金颗粒也会黏附在捕获抗体带上。
如果检测结果观察时间较长,如超过 15min 时,膜会变干从而导致多余金标粒子
从吸收垫向干燥后的膜回流。这是由干干燥后捕获抗体非常疏水,从而导致胶体金颗
粒从吸收垫流向干燥后的捕获抗体。
3.化学试剂问题 有些快速检测试纸条生产厂家在生产环节中会对硝酸纤维素膜进行封闭。对特定样品进行检测时,硝酸纤维素膜的封闭从层析分离(吸水物质)转变成非层析分离(非吸水物质),目的是提高样品和金标粒子在膜上的流速。
采用在蛋白溶液或表面活性剂溶液中浸泡进行封闭膜时会冲掉一些化学试剂,这些掺入膜中的化学试剂是膜生产厂家为避免膜完全干燥和保护其疏水性而预先设计的。
因此,冲掉一些化学试剂后的膜会较前更干燥,并目会使膜具有事强疏水性,从而在
捕获抗体带造成更加普遍的背景染色或假阳性信号。
采用过量蛋白或表面活性剂进行膜封闭会导致在样品流动过程中产生高黏性从而降低样品层析率。用不合适的反应液进行膜封闭会改变捕获抗体特性,通过电荷作用力、疏水作用力或氢-硫作用力的提高会使捕获抗体具有更大黏附性。因此,最好这些情况下进行膜封闭,例如当需要提高样品或胶体金颗粒流动性和需要降低反应物浓度时。
不论是捕获抗体、标记抗体或者样品保护剂都会产生一些假阳性结果,比如实验中添加硫柳汞(含硫和汞的化合物)和赖氨酸(一般在pH<10.4带有大量正电荷)时要特别注意。
4.样品问题 许多样品中含有能够与金标粒子或捕获抗体发生非特异性结合的物质并能产生非特异性结果。举例来说,一些含细菌的样品,样品中细菌非常疏水,目这些细菌会被部分破坏成细胞碎片,这些疏水的细菌碎片也会与捕获抗体和金标粒子发生交叉反应。
此外,一些样品会含有高浓度硫或 SH 基团或带有很高正电荷,一些样品会含大量分子或细胞分子,这些都会阻塞膜并对检测带上金标液的流动产生干扰。
另外,样品在酸性条件变化会非常大。例如,尿液样品最初pH 值 4~7、随着细菌含量增加,样品pH值会随之降低。流动过程中酸性样品会在捕获抗体表面产生正电荷,与带负电荷的金标粒子发生非特异性反应。如果样品含大量酸性物质或者带大量正电荷蛋白质,这些酸性物质或者正申荷蛋白质在到达捕获抗体区之前可能与金标粒子发生非特异性结合,不仅掩盖待测物与金标间粒子的结合信号(即降低特异性信号效果),还增加与膜上捕获抗体带上其他蛋白的的结合。
三、对假阳性结果的补救措施
无论偶尔还是重复出现的假阳性结果, 最合适的补救措施是对此类问题采用系统
诊断方法。图 5-11 是系统诊断假阳性信号的的流程图。
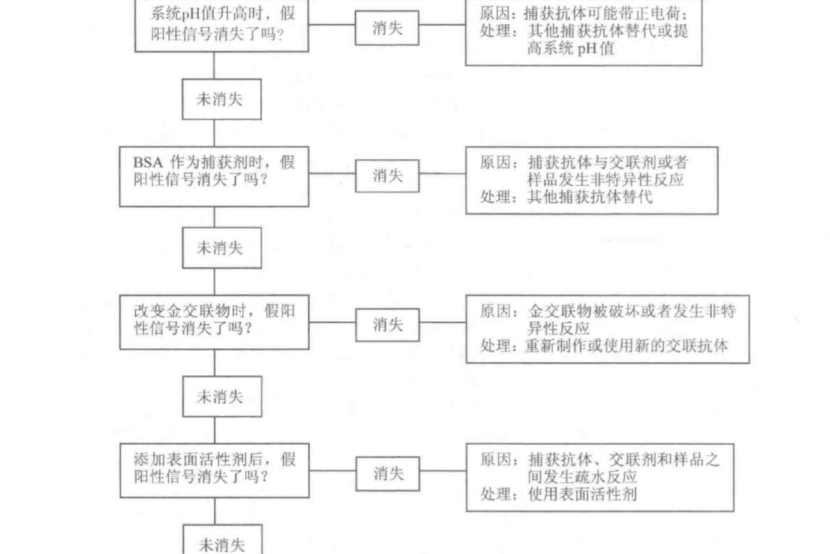
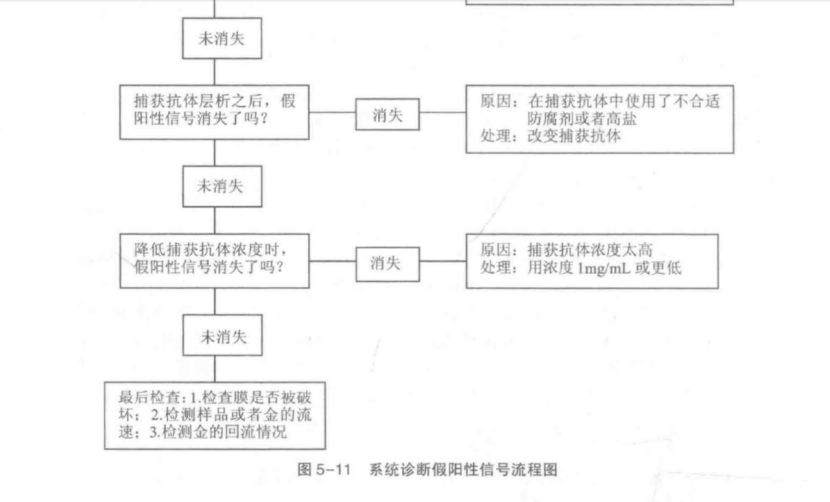
产生假阳性的主要原因首先是金标粒子与捕获抗体的反应,特异性电荷吸引力、疏水作用力和金-硫结合力:其次应注意抗体、特殊样品特性和跨膜流动特性的非特异性交叉反应,通过对照以上诊断流程能够迅速找到问题根源。
对任何系统诊断方法来说,采用排除法进行对照时只能改变一个参数。举例说明如下:①电荷。检测体系 pH值的变化(pH值5~11)可以了解正电荷是否存在和胶体金颗粒与捕获抗体是否结合。②疏水作用。这可能发生在固相中的捕获抗体区或金标区。改变体系中表面活性剂浓度对于分析疏水作用是否是主要原因可提供帮助。③金- SH 吸引。最有可能发生在捕获抗体带和样品浸人带中的半胱氨酸和精氨酸基团。对这两个区域的仔细检查可以找出问题所在。
二、假阴性产生的原因
与假阳性信号诊断流程相比,引起假阴性信号的诊断流程需要考虑更多因素。主要是因为研发人员常常是在开始没有可见信号的一无所知情况下进行实验的。不过,解决此类问题的方法仍然依赖于对照线的出现与否以及及样品和金标液沿着膜带的流动情况等方面进行考虑分析。表 5-2 总结了产生假阴性信信号可能的大多数原因。

下面主要对绝大多数阳性样品中偶然产生的假阴性结果进行详细分析。图 5-12简要说明了产生假阴性结果的最常见原因。如果在临庆阳性样品中所有的检测线(带)均产生假阴性,那么可能是检测线(带)的设计有问题。假阴性产生大部分原因是由捕获抗体和金标液引起,再就是检测体系中膜的流动性不好(流速太快或太慢)、金颗粒释放不充分、盐量不足、体系中酸度不适宜。另夕 ,以下几方面也需注意:检测前 对样品进行处理能让抗体与抗原更好结合;对样品进行稀释可避免 hook 效应发生率:通过改变样品成分可避免一些特殊抗原的假阴性发生。
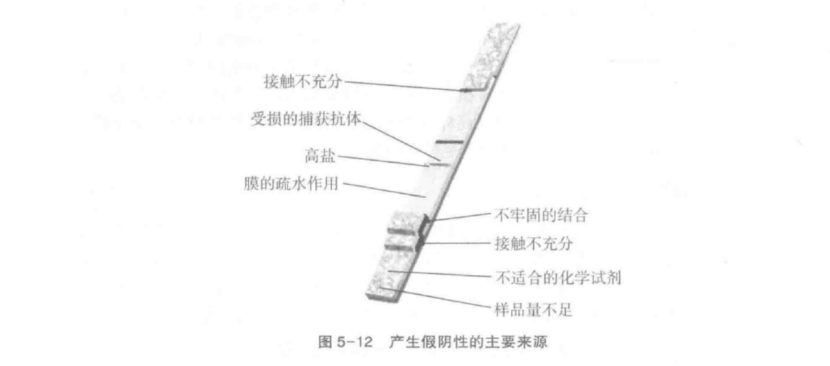
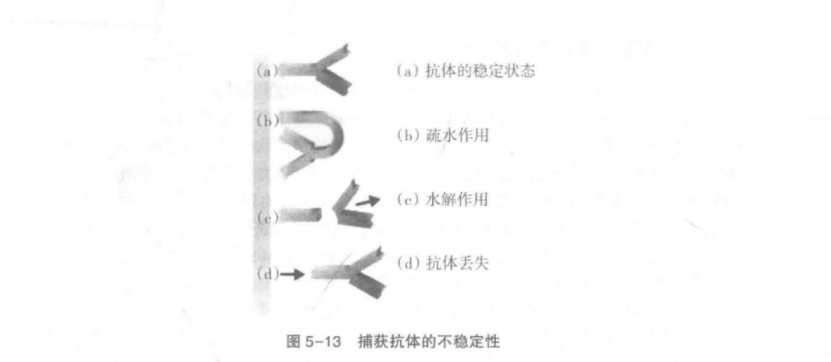
捕获抗体在储存过程中会变得不稳定目失去特异性活性,可能是由于水解作用(潮湿环境和干燥不充分)引起的,也可能是由于疏水作用被破坏(图5-13)。后者可能由于抗体自身特性引起,通过更换抗体或去除捕获抗体层后用表面活性剂处理膜即可解决。另外,抗体或金标液潜在的不稳定性要求检测应当在可控干燥环境下进行。
假阴性产生原因常常是由样品、金标液,或膜的流动性引起。很多因素都能导致类似现象发生,如样品量不足、金标液或样品垫上糖量不足、标记垫和膜结合不紧密或者标记垫材料不适合。这些因素可通过没有控制线(带)的试纸条进行检测分析。如果金标液暴露于潮湿环境,那么其中的糖很可能会结晶从而导致金颗粒不能在膜上移动。
假阴性还有另两个产生原因,一个是捕获抗体或金标液没有发生免疫反应:另一个是在样品加入时膜上捕获抗体丢失(图5-12)。假阴性的产生也经常是由于金标在干燥和水合过程中被破坏,有没有控制线(C线)说明金颗粒在样品加入时是否被充分释放,但不能说明捕获抗体质量好坏或抗体免疫活性大小。
总之,快速检测试纸条的研发需要经过实验室小试阶段、中试阶段,最后进入大批量生产阶段。每一个阶段出现问题都必须再经过几周甚至几个月时间重新进行研发。
在这个过程中,优化检测技术,完全熟悉实验机制,对产生假阳性、假阴性结果的原因进行分析都需要花费大量时间和精力。当然可根据经验对一些问题做出判断。但不是每一个生产人员都具有丰富生产试验经验。所以,掌握实验机制并对假阳性和假阴性产生的可能原因做出较快判断,无疑可节约大量时间、材料和资金[1]。
三、胶体金试纸样品垫上样不吸收的原因
这个时候首先要确定样品垫的材质。根据选用的样品垫材质决定是否进行预处理,如果选用的是玻璃棉,多数产品出厂前已做亲水处理,可直接使用。如选用的是聚酯棉,则需要对其进行亲水性处理。采用浸泡工艺样品垫进行预处理,可使其受表面活性剂充分接触而获得充分的亲水性。也就是说样品垫是否具有亲水性不仅要看材质,还得看是否进行了预处理。
要解决这样的情况,如果层析膜本身就是疏水性的,出现这样的情况很正常,建议在处理液中加入一定量的表面活性剂如果是亲水性的,出现这样的情况,可能是BSA固化引起的,建议加一些T-20同时降低BSA的使用量。
四、胶体金C线不明显的原因
如果检测线明显,但二抗线不明显,问题不大,可能是二抗线的点膜浓度低了,或者因阳性过高导致检测线结合和大量的金,自然对照线颜色变浅。如果检测线也不明显,基本就是标记有问题了,需要重新寻找适合的标记条件。
选择适当的层析膜后,即可在膜真上印迹检测线和质控线。以美国 BIO-DOT公司 XYZ-3000 型点膜仪为例,通常 蛋白溶液在膜上的点样参考量为1uL/cm, 喷点溶液在膜上扩散,干燥后形成检测线或质控线印迹,可通过点样量调整印迹的宽度,点样量越大则扩散后形成的印迹越宽,反之越窄(图 7.24)。

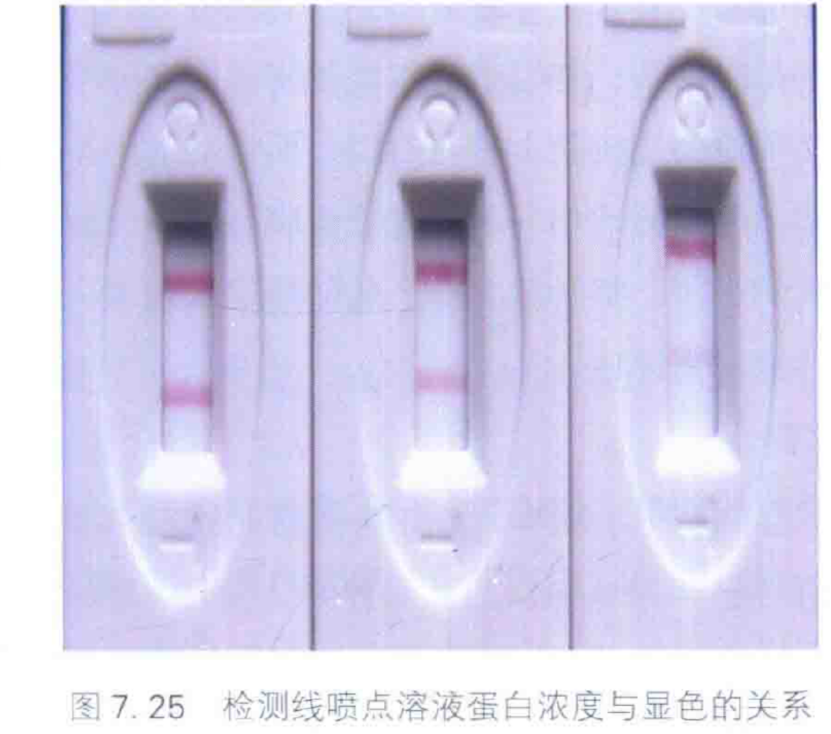
如果检测线或质控线的显色过重或过浅,可以调整喷点溶液的蛋白浓度。如图7.25 所示,试纸质控线蛋白浓度均为2mg/mL,检测线分别为2mg/mL、1mg/mL、0.5mg/mL,检测同一样品时检测线的显色程度随喷点溶液的蛋白浓度降低而减弱。
环境湿度也是点膜的重要影响因素,最佳湿度一般在 15%~35%。湿度过低,膜上容易聚集静电荷,点膜时容易出现疏水斑,此时可以添加适量的醇类物质(如甲醇)加以改善(图7.26)。湿度过高,膜上毛细作用加强,点膜容易引起检测线或质控线变宽甚至扩散,严重时会造成层析膜结合蛋白的能力急剧下降。为了保证点样时层析膜湿度的均一性,一般在点样前应将层析膜置该湿度条件下平衡。

五、胶体金吸附的玻璃膜在NC膜上跑不动的原因
1.胶体金形状不规则,很容易死;
2.胶体金缓冲液问题需要加一些表面活性剂,用来释放,建议加T- 20,若效果不理想可以加SDS-L或SDS-F;要加BSA和PEG来保护抗体;
3.标记垫处理不好标记垫要喷糖来封闭玻璃纤维,避免胶体金和其静电吸附;添加温和的表面活性剂如SDS-L来增加释放;
4.样本垫如果上述情况都没有问题,但效果仍然不理想,那么在样本垫加SDS-L,浓度可以加大7%试试。
六、胶体金灵敏度降低的问题
1.首要是干燥,含水量越高,活性越容易丢失。环境湿度尤其重要,还有烤的要干;
2.铝箔袋的密闭性要好,不要贪便宜买差的铝箔袋;
3.加稳定剂。蔗糖、海藻糖、PVP、L-30、L-90D,and so on;
4.此外,影响试纸产品灵敏度和特异性的因素还有很多,如层析膜的宽度以及检测线在膜上的相对位置,它们同样会影响试纸产品最终的性能。点样位置越靠近手柄端,免疫标记复合物通过检测线的时间越滞后,反应时间相对增加,可使试纸的灵敏度升高,反之灵敏度降低[2]。
六、总结
快速检测试纸条的原理和设计理论比较简单,总原则是不能认为一个检测产品中的最佳方案的每一步都适合于其他检测产品,另外,样品和待检成分种类非常多,不是所有抗体都是以同一作用方式进行反应的。每个生产厂家膜性能特征都不一样,需要对同一来源的膜或不同批次的膜进行重现性分析。
采用最佳工艺过程和最合适材料能够获得最佳结果。要生产出高质量的快速检测试纸条,生产者不仅需要对所有参数和相关知识进行全面了解,而且应该清楚影响产品稳定性、可信度、重现性、灵敏度和特异性的因素。只有熟知每一个产品组件工作的机制,其中包括流体动力学和使用系统方法进行错误结果引起原因的诊断,才能保证生产出优质的快速检测试纸条[1]。
参考文献:
[1]刘丽,胶体金免疫层析技术,[M].郑州:河南科学技术出版社,2017.9.
[2]张改平,免疫层析试纸快速检测技术,[M].郑州:河南科技技术出版社,2015.
注,文章来源于微信公众号《医学检验废品加工车间》,如有侵权请联系我们删除