什么是极性溶剂?
极性是指分子中电荷分布不均匀,从而导致分子在电场中具有一个正电性朝向和一个负电性朝向的性质。极性分子的电子云密度不均匀分布,使得分子在空间中有一个明显的电荷分布方向。例如,水就是一个极性分子,因为氧原子电负性大,吸引电子效应强,使其周围的电子云密度更大。
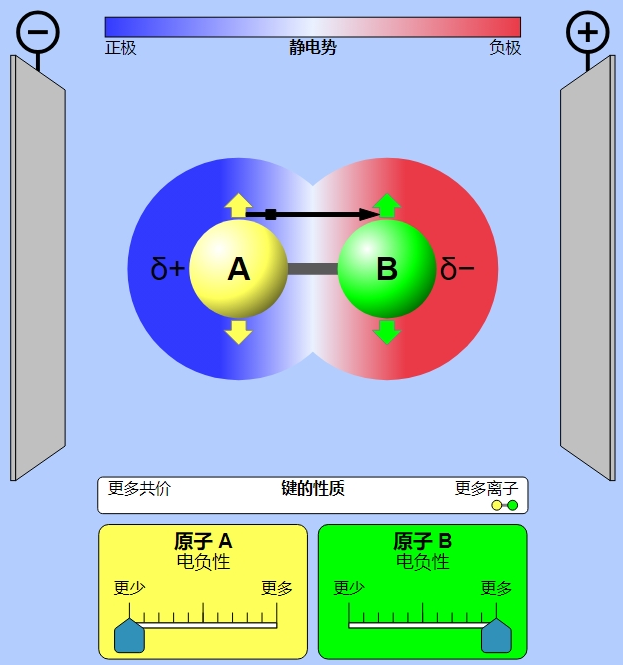
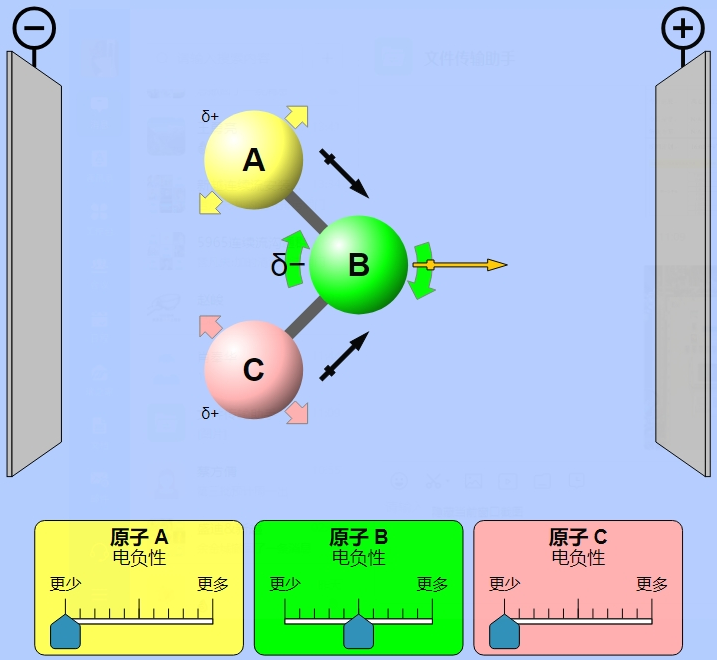
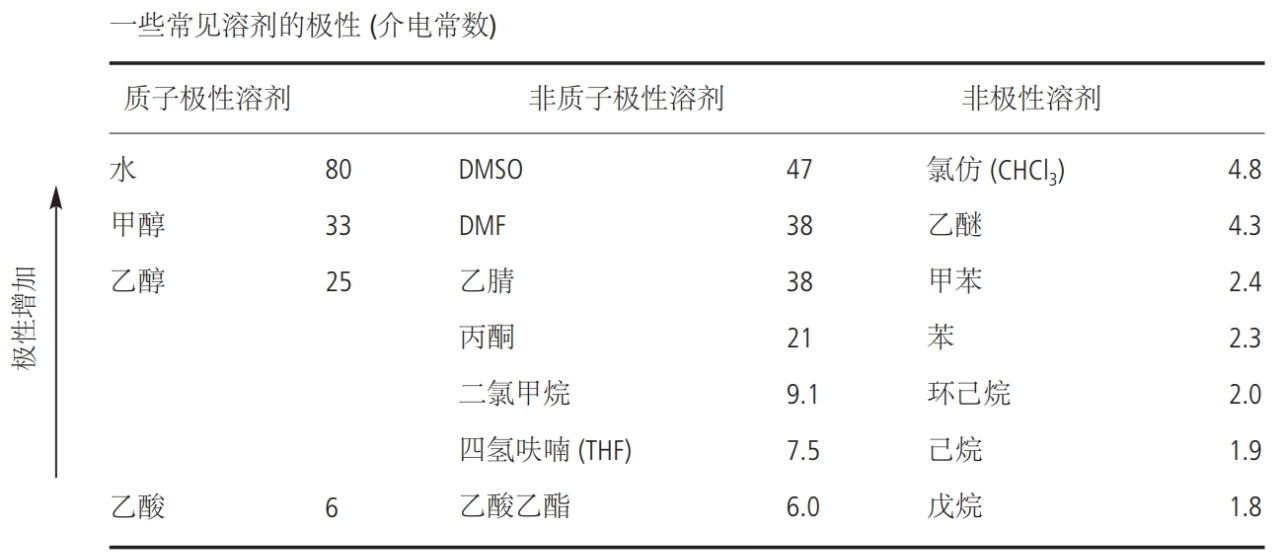
根据分子极性的不同,溶剂可分为极性溶剂和非极性溶剂。例如甲醇、水等,都属于极性溶剂;如苯、乙醚等,都属于非极性溶剂。溶剂的极性大小可以通过测定溶剂的介电常数进行判断。另外,根据是否可以电离出质子,溶剂还可分为质子溶剂和非质子溶剂,如水、乙酸等,均属于质子溶剂,又可称为质子极性溶剂。
水为什么可以溶解无机盐?
水可以溶解无机盐的原因是水可以溶剂化无机盐的阴离子和阳离子。例如水溶解溴化钠,是因为其氧原子上的 δ–可以稳定正电性的钠离子,氢原子上的δ+可以稳定负电性的溴离子。
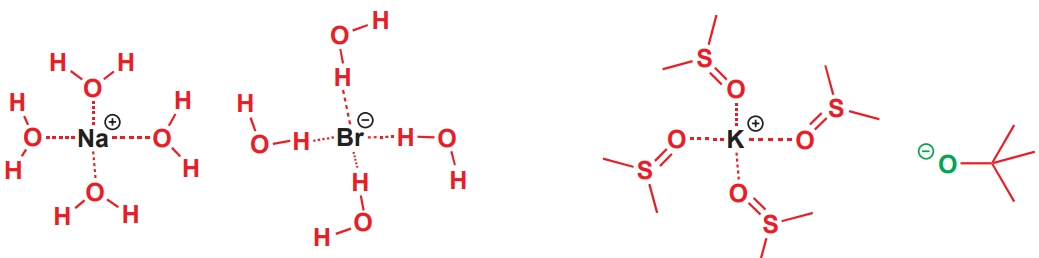
DMSO氧原子上的δ–同样可以溶剂化阳离子,但由于它们并没有可接近δ+区域,因此溶剂化阴离子的能力会差得多。t-BuOK在DMSO中可以使酰胺水解,而使用DMSO作为溶剂的原因就是它可以溶剂化K+离子,使t-BuO−因没有得到溶剂化而不稳定,它渴望通过找到一个质子变为中性分子,即作为碱消耗掉过渡态中的质子。
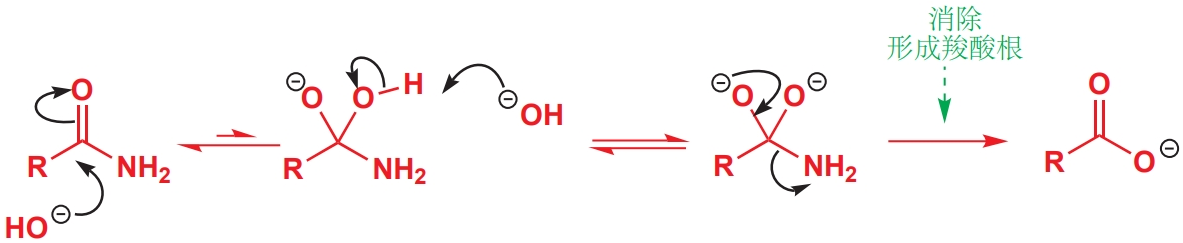
溶剂是如何影响化学反应的?
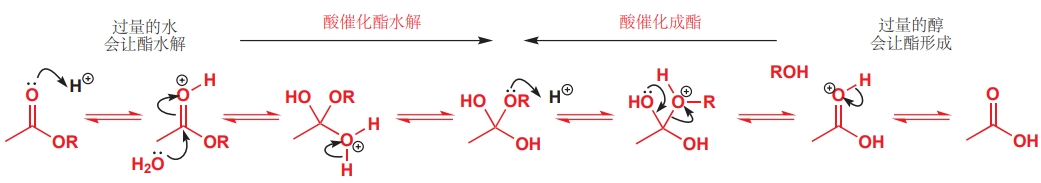
溶剂可以作为一种反应物参与反应。例如,在水中酯可以发生水解,在醇中酯可以生成,这是因为溶剂在溶解反应物的同时还是一种试剂,因其具有较高的浓度驱动了反应朝产物方向进行。
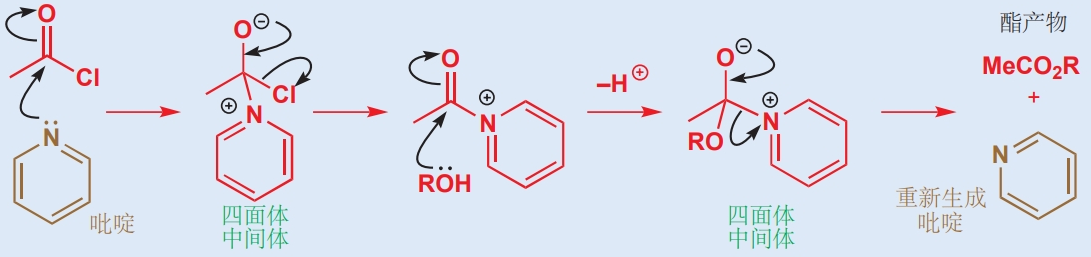
溶剂可以作为一种催化剂催化反应。例如,由酰氯与醇生成酯的反应通常在吡啶溶剂中进行,因为吡啶在溶解反应物的同时也能作为催化剂。
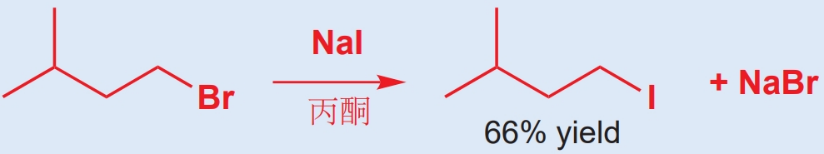
某些盐在有机溶剂中的难溶性,可以被用来驱使平衡向所需的方向发展。例如,由溴代烷与碘化钠合成碘代烷时,我们会选用丙酮做溶剂。这是因为碘化钠在丙酮中的溶解度远大于溴,因此溴化钠会沉淀出来,这会导致有更多的起始原料转化为产物用以复原平衡常数。
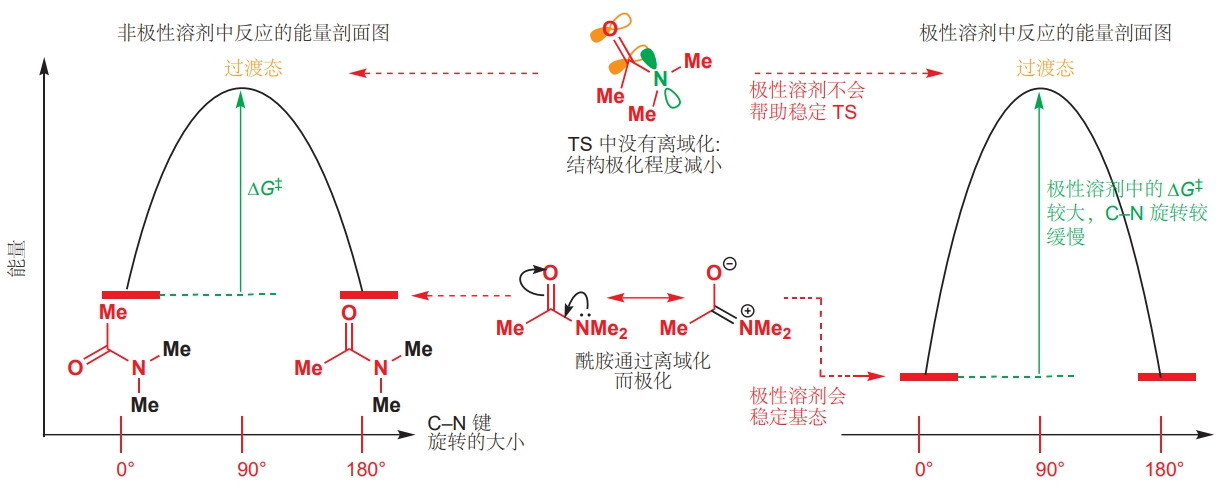
依靠溶剂溶解带电荷物种的能力,溶剂可以通过使过渡态或中间体稳定化或去稳定化。例如二甲基乙酰胺在不同溶剂中发生C–N键旋转的速率有明显差异,这是因为基态的酰胺是离域的,极化程度大;而C–N键旋转形成的过渡态的极性弱于基态。极性溶剂可以稳定极性的基态,使之能量降低,因而在极性溶剂中,由基态到过渡态所需要获得的能量相比于非极性溶剂中更多,C–N键旋转也更缓慢。
参考资料:Jonathan Clayden etal., Organic chemistry,delay译
备注:文章来源于《化学笔记》公众号,如有侵权,请联系删除